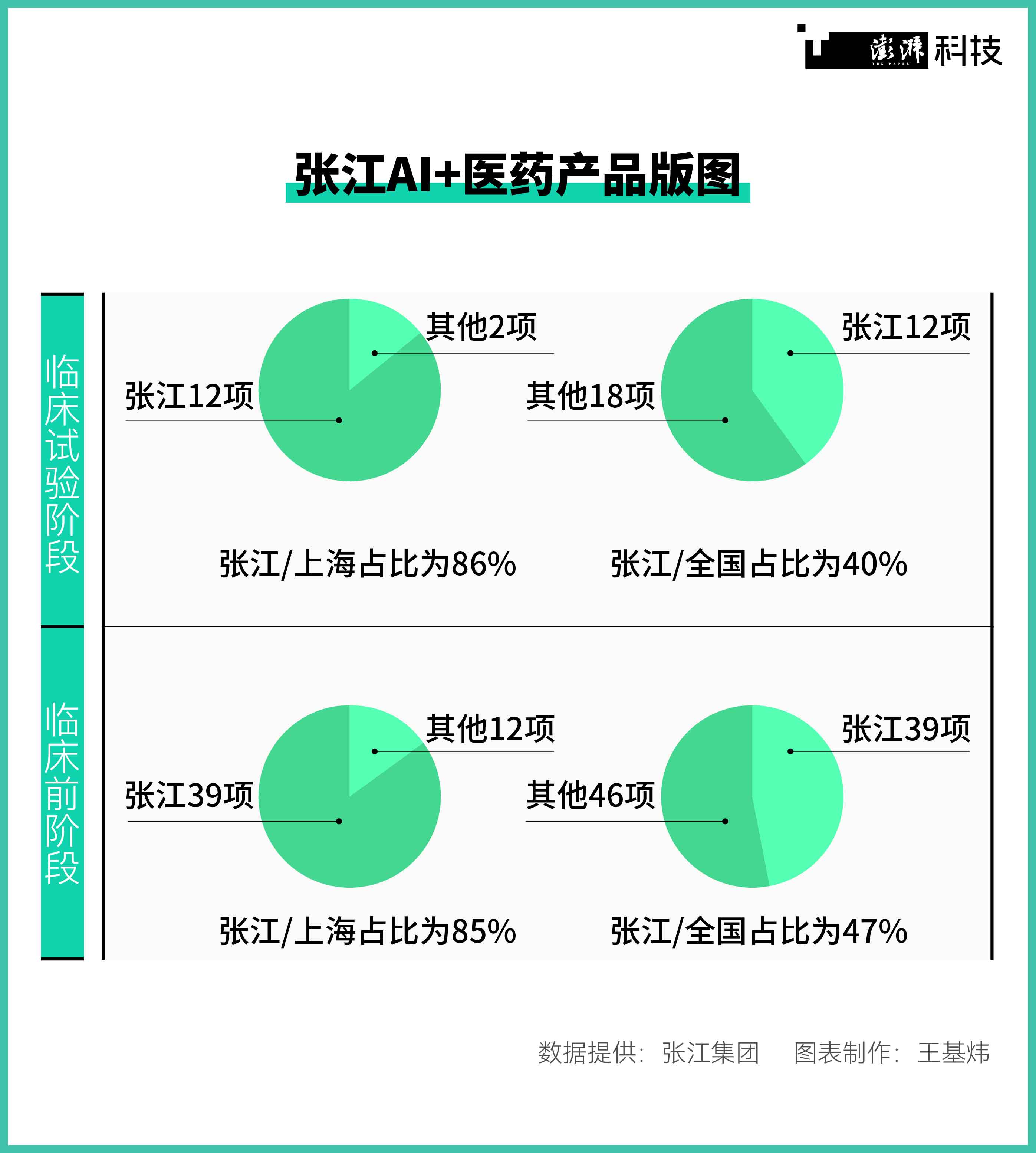
张江AI+医药产品版图。
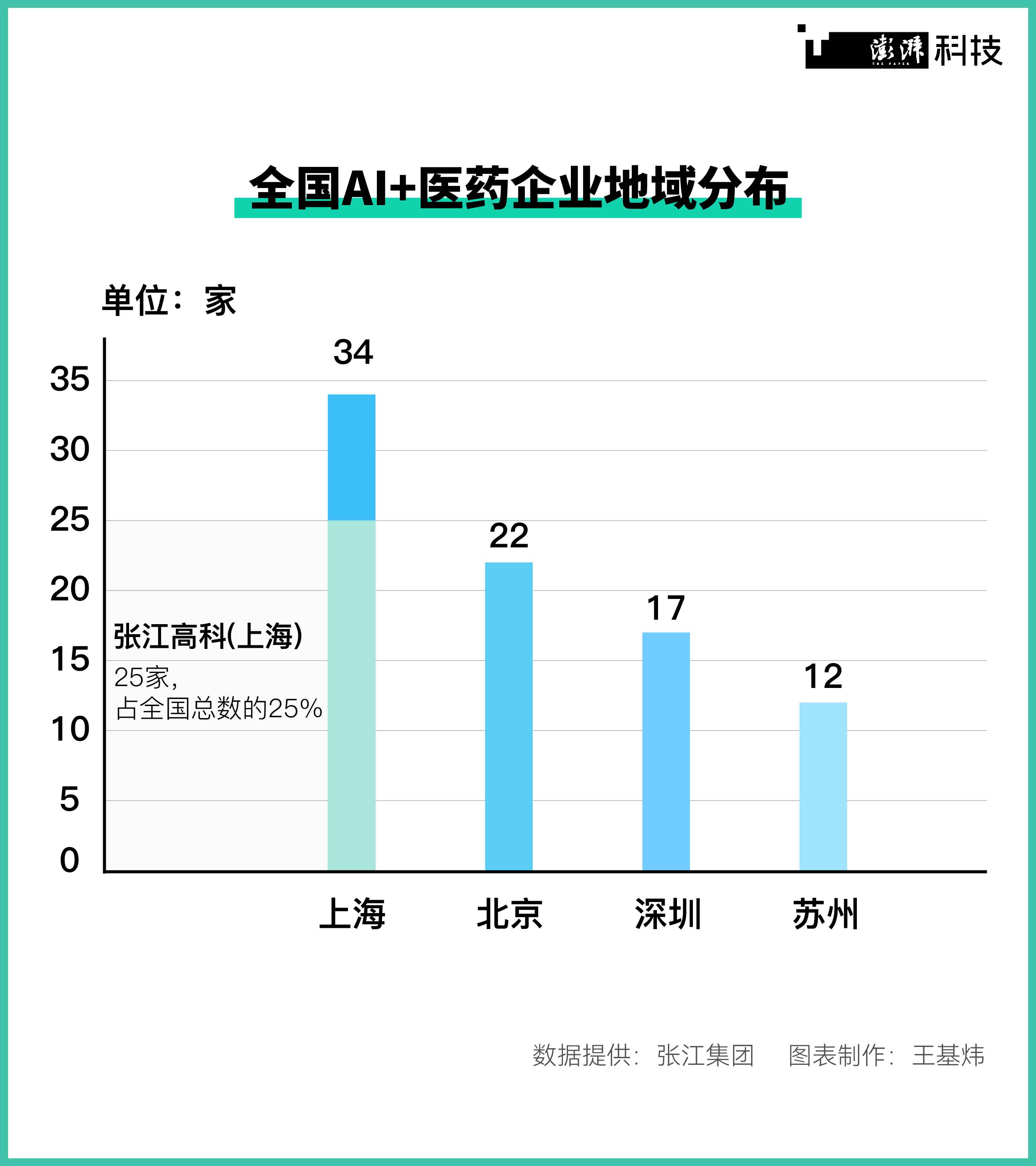
全国AI+医药企业地域分布。

亚洲地区AI医药企业投资(截至2022年第四季度)。

国内AI医药市场规模和空间预测。

国内AI+医药产品临床开发进展。

全球50家代表性AI制药企业。

【编者按】潮涌科创,澎湃开局。上海市经济和信息化委员会、澎湃新闻联合推出“上海新型产业体系重点领域大调研”,聚焦上海“3+6”产业体系、新赛道和未来产业的重点行业领域,锁定船舶与海洋工程装备、氢能汽车、机器人、智能工厂、新材料、智能终端、人工智能、元宇宙、数字经济、生物医药等产业,深度调研上海产业高质量发展态势和未来趋势。
今年一季度,全球已有超过28笔对AI制药公司的投资,平均投资额3800万美元。在中国AI制药版图上,上海张江占据龙头位置。到2025年,张江药谷“AI智药生态”有望集聚300家活跃机构、30个创新联合体和30个赋能平台,AI有望助力每年新增30条一类新药管线。AI加速靶点和药物发现的实力,已经有目共睹,真正的考验还在临床阶段。

张江AI+医药产品版图。
2023年初,当ChatGPT(美国OpenAI研发的聊天机器人程序,于2022年11月30日发布)风潮席卷全球时,AI制药,即人工智能驱动的药物研发,也站上了新的风口。
据AI咨询机构Deep Pharma Intelligence统计,截至2022年12月,全球800家AI制药公司的总投资额达到59.3亿美金,9年间增长了27倍。而今年第一季度,已有超过28笔对AI制药公司的投资,平均投资额为3800 万美元。
在中国AI制药版图上,“老牌药谷”上海张江占据着龙头位置,从企业数量到管线规模都领先全国。张江集团据公开披露信息统计,目前全国共有99家企业涉及AI+医药领域,其中上海34家,张江企业以25家的数量在全国占比达25%;全国AI+医药产品在临床前研究阶段和临床试验阶段的项目分别有83项和30项,而张江在全国占比分别为47%和40%。
2021年10月,在陈凯先、蒋华良、饶子和三位中国科学院院士的倡议下,张江AI新药联盟应运而生。到2025年,张江药谷“AI智药生态”有望集聚300家活跃机构、30个创新联合体和30个赋能平台,AI有望助力每年新增30条一类新药管线(pipeline,指药企一批正处开发阶段的药物,包括临床前、临床研究等)。
如今,AI加速靶点和药物发现的实力,已经有目共睹,真正的考验还在临床阶段。继Exscientia公司停止开发全球首个AI设计进入临床试验的药物之后,最新的坏消息是,另一家英国AI制药头部企业Benevolent AI近日宣布,一款用于治疗特应性皮炎的候选药物,在二期临床试验中未能达到次要疗效终点。
未来哪一款AI辅助设计甚至从头设计的药物,能率先成功穿越二期临床试验的“死亡之谷”,只有时间能给出答案。但不可否认的是,随着越来越多制药企业向AI敞开怀抱,AI赋能药物设计已然势不可挡。

全国AI+医药企业地域分布。
AI制药“迎难而上”
生物制药行业长期流传“双十”规律,即从新药研发开始到最终获批上市需要平均耗时十年,投入成本约十亿美元——许多行业报告估计的数字还要数倍于此。除了周期长、成本高,制药还是一项高风险的事业,据业内估计,全球新药研发的成功率仅在2%到15%之间。
新药开发为什么这么难?一方面,人类蛋白质组中,难成药靶点占了75%以上,常规靶点即将开发殆尽,赛道格外拥挤;另一方面,一款候选药物必须综合满足多个维度的条件:溶解度、活性/选择性、毒性、代谢、药代动力/药效以及可合成性。
至今,60%疾病无有效药物,50%到70%的患者对重磅药物无响应。大量临床需求未被满足,业界迫切需要新的药物研发工具和范式,AI因此吸引了大量创业者和投资人的目光。
2012年之前,AI技术在药物研发中的应用还处于早期探索阶段,主要包括靶点识别、药物分子设计、虚拟筛选等方面。此后五年时间里,随着机器学习、深度学习等技术的日渐成熟,AI在药物发现中应用的优势日益扩大,应用范围也扩展到了临床试验设计和预测、“老药新用”(repurposing)优化设计等场景。
2017年被视为AI制药产业化落地阶段的起点。当年9月,美国AI制药初创企业Atomwise宣布获得4500万美元的融资,成为AI制药领域最大的一笔融资。AI制药的标志性企业,如英国Exscientia、美国BenevolentAI,也在这一年相继取得重要突破,利用AI开发的小分子候选药物(小分子药物主要是指化学合成药物)开始涌现。
总部位于中国香港的英矽智能(Insilico Medicine)是全球首家探索使用生成性对抗网络(GAN)和生成式强化学习(RL)人工智能技术进行药物发现的公司,已成为AI制药领域的领头羊之一,主导药物研发的上海研发中心就落户张江。2021年2月,英矽智能宣布,全球首次利用人工智能发现具有全新靶点和新分子结构的候选药物INS001-055,用于治疗特发性肺纤维化。
从靶点发现到提名临床前候选化合物,英矽智能仅花费了数百万美元研发经费,耗时18个月,令业界瞩目。2022年3月,该药获批在中国进入I期临床试验阶段,这也是中国首个进入临床的AI药物。2023年1月,英矽智能发布I期临床试验积极的顶线数据。同年2月,英矽智能宣布该候选药物获得美国食品药品监督管理局(FDA)孤儿药资格认证,即将启动II期临床试验,为AI制药前景注入更多想象。
澎湃科技访谈的多家张江企业表示,AI制药并非横空出世,而是传统计算机辅助药物设计(Computer Aided Drug Design,简称“CADD”)的延伸和进化。
“随着深度学习技术的提高,AI制药这个概念越来越多的被特别地提出来,原来其实很多地方已经在运用AI。”张江AI新药研发联盟轮值主席、美迪西创始人兼CEO陈春麟介绍,从早期随机筛选候选药物分子,到后来通过计算机模拟技术预测小分子化合物的理化性质,再到结构生物学兴起后,基于对药物与蛋白质间相互作用机制和结合位点特征的探索,药物发现和优化过程开始变得更具有预测性和可控性。
“但这些都还只是点上面的变化。人类的经验只能局限在某个领域,比如一个人很擅长合成某个序列的化合物,换个序列,经验可能就不准了。”陈春麟说,美国化学家Christopher Lipinsk曾提出药物设计的五项基本定律(“Rule of Five”),“现在AI可以综合考虑这些多方面因素,这是AI带来的最大的突破。因为数据库变多了,虽然还不是最全面。”
深势科技生物医药事业群副总裁范梦奇谈到,AI可以加速分子虚拟筛选,帮助在更短的时间内筛选更大的化学空间,助力苗头化合物的发现。同时,借助自由能微扰(FEP)算法,可以在先导化合物优化阶段进一步加速。“比如在传统范式下, 优化阶段可能要设计并合成几百个分子,等待数月的合成和生物实验时间,现在设计好的分子可以先用FEP计算亲和力,淘汰活性不够的分子,最终只需合成活性靠前的进行生物实验,就可以节省很多时间和成本。”

亚洲地区AI医药企业投资(截至2022年第四季度)。
重新定义“结构为王”
2018年12月,DeepMind(英国人工智能公司,2014年被谷歌收购)构建的蛋白质三维结构预测平台AlphaFold,在CASP13比赛(国际蛋白质结构预测比赛)中展现了惊人实力,与实验室解析的结构精度相当。不到两年后,AlphaFold2再次刷新该领域的纪录。2021年7月,DeepMind公开包含数百万种已预测的蛋白质结构数据库,供科学家和研究人员使用,成为AI for Science的重要里程碑。2022年7月底,DeepMind 再次宣布,AlphaFold DB 已从 100 万个结构扩展到超过 2 亿个结构,扩大超过 200 倍。
锐格医药首席科学官钟闻歌指出,AI工具预测准确度与已知的蛋白质结构有很大关联。对于药物分子设计而言,蛋白质构象的动态特性尤为重要。“结合口袋的变化是个关键点,但变得越多、越是动态的蛋白质,AI工具的预测越具有不确定性。特定氨基酸残基的微小偏差甚至结合口袋里有没有水分子,可能对AI结构预测来说已经做得够好了,但对猎药人来说,却是涉及到药物是否有活性、能否成药的差异。”
范梦奇同样认为,目前AI预测的结构精度,离实际做药的要求还有一定距离,尤其是在口袋附近,对预测的准确度要求更高,因而还需要结合动力学模拟等手段,对其进行进一步的精修。
2022年5月,深势科技发布了一款基于分子三维结构的通用分子表征学习框架Uni-Mol,结合2亿个小分子数据和300万个蛋白口袋数据共同训练。范梦奇称,在这一预训练模型基础上,只需要再利用少量的数据进行微调,就可以达到远超于以往模型的预测精度,目前Uni-Mol在15个公开测试集中的14项均夺得第一,分子表征能力很强。
深势科技也成功把Uni-Mol应用在了例如材料设计等更多领域。“最近,我们对Uni-Mol的模型框架进行了大幅升级,推出了Uni-Mol+,并在国际权威学术竞赛OGB-LSC的量子化学性质预测上获得了榜首。未来它将助力深势科技Hermite®药物计算设计平台计算更为精准。”范梦奇说。
据其介绍,传统CADD往往是基于传统的分子动力学(MD)采样,模拟动态过程,但在计算一个较大的蛋白体系时,很难捕捉完整的构象变化。深势科技打造的RiDYMO™ 强化动力学平台,用AI捕捉蛋白质动力学变化,探索完整的构象空间,可以赋能蛋白质功能研究以及别构/变构体系,找到候选药物分子。
他举例说,公司有一条肿瘤治疗的自研管线,利用了强化动力学方法发现苗头化合物,“这个靶点是一种固有无序蛋白(IDP),在人体内缺乏稳定的三维构象,以往传统的CADD方法对这类蛋白无法有效描述,更无从谈起理性的从头开发。”
“我们不强调研发时间多快,而是真正聚焦于项目本身的立项逻辑,尤其对一些潜力巨大但还未成药的难成药靶点,拼赶的并不是时间。当你看到一些别人还没看到的东西,先去开发到一定阶段,再去寻找合作,也是非常好的方式。”
而在钟闻歌看来,“AIDD(AI Drug Discovery),在创新药研发的很多环节发挥着很大的作用,但它的全面实现可能还需要很长时间。”
“结构生物学是锐格医药的‘基因’。”钟闻歌表示,锐格医药定位为“植根中国、全球布局”的创新药企,选择两条腿走路,一是利用自主研发的rCARD™平台,借助计算生物学、结构生物学、计算化学等工具,进行复杂的计算机建模;二是直接解析蛋白质结构。目前锐格医药已与中科院上海药物所以及维亚和水木未来等业内顶级的结构生物学团队合作解析了近百个蛋白质复合物结构,其中包括5个冷冻电镜结构。
“我们锐格自主创建的rCARD™平台,在内部技术层面已经得到验证。”钟闻歌介绍,通过人机结合、干湿试验结合,锐格医药花了十个月发现高活性高选择性的候选药物RGT-419B分子,实现了CDK4/2/6抑制剂开发中选择性活性的复杂平衡。目前RGT-419B中美一期临床试验正在进行中。
“我们的态度是拥抱技术,拥抱未来。”钟闻歌说,锐格医药在两方面发力,一是将过去CADD的被动辅助思维转化为主动思维,由信息和计算指导分子优化设计;二是积极采用现有的好用的人工智能算法并和世界一流的人工智能团队合作开发全新的方法。“我们不是纯粹为了技术而技术,做任何事都以创新药的研发为目标。”

国内AI医药市场规模和空间预测。
AI祛魅,行业回归理性
“此前有一批大大小小争先布局AI赛道的公司,如雨后春笋势头迅猛,但最终并未交付出让市场满意的结果,也就是与现有CADD差别不多。”罗氏中国加速器负责人唐秋嵩回忆。
“现在什么都冠了AI,包括细胞治疗也冠AI,我认为有点夸张了。现在也说AI能够设计抗体、蛋白质、RNA等等,实际上目前来说我认为最成功的还是小分子药物设计。”陈春麟认为,小分子化合物历经百年研究发展,拥有大量的文献记录和方法积累,能为AI学习提供厚实的基础。因此AI最容易实现突破的领域,就是分析合成小分子化合物,预测药物进入人体的毒性作用。
美迪西是一家积极拥抱AI技术的CRO公司,据公司内部统计,在不同的案例中,加入AI确实能提高药物设计的速度和有效性,从而提升医药研发的效率。不过,陈春麟对于AI制药仍抱以理性和谨慎乐观的态度。
他坦言,AI药物设计不是万能的,目前还无法脱离人的共同参与,“有时计算机设计出来的分子,合成反而困难,甚至是难以逾越的障碍,比如某些共价键没法合成出来。尽管出现这个情况的概率比较小,但这也说明药物研发不能完全交给AI主导。”
“药物研发是一个不断试错的过程,无论是基于AI平台还是基于传统实验的药物研发,都需要在多次测试的基础上不断分析迭代,才能筛选出最优化合物。因此AI技术与传统CRO可以说是在互惠共生、融合促进中共同催化药物研发在速度、难度、广度上取得突破。”
陈春麟笑称,自己当初想要推动张江AI制药联盟,正是因为CRO公司在AI制药生态圈里也有重要的一席之地:很多AI技术公司没有湿实验室,会选择与CRO公司开展实验合作,对算法进行验证;同时CRO公司也会付费使用AI计算平台端口,帮助自身的新药研发。
“AI慢慢就变成工具,我自己不需要再去建平台,我可以用这家的产品,也可以用另一家的。可以说,AI促使了多种新型合作模式的出现,不仅能让整个医药研发的行业更加繁荣,也能促进各家公司加强合作。”陈春麟介绍,美迪西与德睿智药、英矽智能等AI公司都有合作,共同推动医药研发技术迭代,为人类健康事业添砖加瓦。
范梦奇也指出,“传统药企现在越来越拥抱AI,明显感觉到它们在布局这方面的人才和能力。另一方面,大家看待AI更理性,之前可能觉得AI可以直接生成分子、上到临床、最终变成上市的药物,现在大家渐渐把AI工具化,也更清楚AI还不能做什么,反而能够更好地拥抱AI,这是一个祛魅的过程。”
他认为,AI制药的发展阶段可以与自动驾驶类比,“现在是AI辅助人类药物发现,替代一部分人工时间,也减少一部分搜索空间,到最终阶段,可以由AI直接推荐出好的药物分子,“这在将来是肯定会发生的,但是到这一天还有非常多路要走。”

国内AI+医药产品临床开发进展。
合作生态逐步成熟
从2016年开始,AI制药公司逐渐演化出三种主要的商业模式:AI+Saas(软件运营服务),AI+CRO(医药研发外包服务),AI+Biotech(创新药企)。
据范梦奇观察,近年来,AI制药行业定位更多元化,越来越垂直和深入到细分领域中解决实际问题,思考也在迭代。企业也开始更清楚AI在各环节可以发挥的作用和自身战略定位,因而在特定的研发阶段里,可以跟不同的公司和工具合作、协同,“这种模式越来越多,合作也越来越轻松,而不是希望一家公司把所有都做全了。”
唐秋嵩也有类似感受。罗氏全球先后与若干家AI制药公司建立了合作,而在中国本土,罗氏中国加速器成员企业中,目前已有两家AI制药企业,分别聚焦于抗体结构预测、剂型筛选和优化,“这些优秀的初创企业的共同特点在于,针对新药研发中的某个特定场景,有其独到见解,清晰地知道要解决的问题是什么。”
“很多AI制药公司都想组建自研管线,并且这些公司也很清楚AI只占药物研发链条中很小一部分,绝大部分的工作仍旧需要在动物实验和临床试验中进行验证。AI公司渴望在短时间里在药物研发能力上对标已在这一领域深耕多年的大型跨国药企,还有很长的一段路要走。”唐秋嵩认为,也有一些投资人希望AI制药公司成为人工智能计算平台或解决方案的提供商,这是一个比较容易理解也相对短频快的商业模式,类似于CRO的角色。
而在英矽智能联合CEO任峰看来,英矽智能的多元发展,得到了合作伙伴的促动和激发。2014年成立早期,英矽智能专注于靶点发现和化合物设计等局部的AI+Saas服务,后来在与大型药企合作的过程中,发现仅仅提供这样的服务不仅难以评估商业价值,且无法有力回应合作伙伴对平台有效性的质疑。
在合作伙伴的建议下,英矽智能一方面将服务向后延伸,形成端到端的早期药物发现,另一方面在内部推进自研管线验证平台的有效性和高效性。目前,英矽智能已成为一家人工智能与药物研发并重的AI制药公司,以人工智能高线赋能管线推进,以管线里程碑验证人工智能平台的有效性。
至今,全球前20大制药公司中有11家授权引进了英矽智能的人工智能药物研发平台。2022年1月,英矽智能与复星医药达成首付款1300万美元的战略合作,为当时国内已披露的首付款最高的订单。当年11月,英矽智能再次刷新记录,与赛诺菲达成合作,预付款和靶点提名费用不超过2150万美元,里程碑总额最高可达12亿美元。这些都被外界视为AI制药获得行业认可的标志。
陈春麟表示,目前药企与AI公司签订合同,仍有一定比例会失败,或者终止项目,因为有的AI平台不如预期设计得那么快那么好,以至于有企业试水后认为“和原来差不多,干嘛要花这个钱”,“AI只是一种技术,一个演进预测而已,使用AI技术能节省早期药物研发的时间和金钱,但要深入预测药物进入体内的毒性药效等情况,还得通过传统医药研发的手段,用实实在在的实验来证明。”
在范梦奇看来,对行业最大的挑战仍是生物科研层面本身的不确定,对靶点机理和疾病机制的研究不足,“这也是我们与科研院所选择合作的原因,我们做工具就是为了解放生物医药工作的生产力。让人类把时间投入到机器和AI解决不了的地方,真正在生物机理研究上发挥更大的思考。”

全球50家代表性AI制药企业。
期待标准化与数据共享
数据、算法、算力,是AI的三大核心要素。唐秋嵩认为,评估一家AI制药公司,主要依据这三个方面:一是是否有足够大规模且质量较高的数据;二是算法能否产生出新的知识或结果;三是算力是否足够强大,需要比传统的CADD快很多。
“AI公司之间的竞争正在慢慢从算法竞争过渡到数据竞争。”任峰表示,由于部分疾病的科研成果有限,数据量不够,也会导致算法的准确性不高,因此英矽智能也建立了智能化机器人湿实验室,计划针对特定需求的疾病类型,开展细胞和动物实验。这个过程将产生一系列数据,供AI平台分析,有望从中能找到一些全新的生物学靶点。目前计划率先开展的领域包括衰老以及尚没有有效药物治疗的特定癌种。“我们希望获得这些专属的数据后,我们能够在这个领域里占据一个领先的位置。”
在自动化实验室布局方面走在前列的还有晶泰科技。2020年9月,它曾以3.188亿美元C轮融资创下全球AI制药融资额最高记录。2022世界人工智能大会上,晶泰科技宣布上海总部将落址张江集成创新园,正在建设全球规模最大的医药研发类自动化实验室工站集群,助力张江打造医疗+机器人世界级产业集成创新区。
晶泰科技自动化实验室的重要意义在于,产生的大量标准化数据,将持续反馈给智能模型,加速迭代。“自动化实验有望解决AI药物研发的数据短板问题,有助于提升整体研发流程的效率和成功率。”晶泰科技联合创始人、CEO马健曾表示。
钟闻歌则将目光拉长到了临床试验开展阶段,项目会产生很多生物大信息数据,比如单细胞数据、耐药性数据,如果能通过合作找到更多大数据,加上内部湿实验验证,将会带来许多药物联用的机会,在临床开发中会有很重要的指导意义。
他看好张江AI制药生态圈在生物信息学上的挖掘,“通过合作,从临床需求出发加深生物学理解,才会导向成功的药物研发,未来在大分子和小分子上都可能有所突破。此外,通过人工智能找到合适的病人设计正确的临床试验,也会有更多成功例子出现。”
机器学习的前提是有足够的高质量数据,这正是大型跨国药企的优势所在。“如果将所有药企的试验数据都开源在一个第三方平台上,大家都可以去分析,或许在一定程度上能够带来一些新发现,可惜因现实因素,暂时无法实现。”唐秋嵩表示,药企积累的海量研发和临床数据,一般不会开放给外部,因此在现在这个谋求创新的时代,药企会更倾向于与已经有一定优势的AI平台合作,分析自己的数据,“不过AI制药公司当然也不希望只做成一家软件公司,我们已经看到了许多新颖的合作模式。”
由于在GPCR结构生物学领域的专业吻合度,以及同在张江的地理上的便利性,锐格医药和上海科技大学、中科院上海药物所等机构联合开发相关的创新项目。比如在和上科大的合作中,他们共同开发了利用AI快速分析小分子的最低能量三维构象的方法。
“AI工具使用的人越多,有反馈数据,也越能优化和迭代。”钟博士表示,希望有一个大家可以数据共享的平台,在那个平台上将特定的AI方法不断优化迭代。但这样的平台,除了对各公司数据共享机制和开放度的巨大挑战外,也涉及到数据规范化的问题,“比如说,每个公司的数据虽然是同一个靶点,但生物测试的条件和细节不同,如何标准化,也是一个很棘手的问题。”
“传统的微观尺度设计,在没有好的软件之前,大家都是在试错,盲目性很强。计算工具的到来就是为了让你至少有一个更清晰的研发方向。”范梦奇也认为,数据问题涉及到生产关系的变革,AI公司所做的是提升对数据的处理方式,而数据的量和质本身更多应是生态型的总体建设,无法靠单一的公司去完成。
在这方面,国外已有先例可供参考:MELLODDY(Machine Learning Ledger Orchestration for Drug Discovery),是一个由欧盟资助的跨国合作项目,创建于2020年9月,主要成员包括来自欧洲8个国家的10个大学和7家生物制药公司。项目建立了专用区块链,使得不同机构间的数据可以无缝集成,为机器学习算法提供更大的数据集,从而提高药物研发的效率和准确性。
成员机构通过平台共享和整合数据,并利用平台提供的机器学习算法,发现新的药物靶点和化合物。去年11月,十家大型跨国药企同意通过MELLODDY平台训练药物发现预测模型,初步研究证明,该“协作”模型优于制药商的独立AI模型。
陈春麟正希望由政府牵头、创新模式,推动AI新药联盟内部互相共享数据。他建议,国家可以以课题驱动,比如设立一个集体攻关项目,按照一定标准评估各个公司最适合参与哪个环节,分配经费资源,政府也可以适当以购买形式支持数据共享。
据其介绍,在上海市经济和信息化委员会牵头下,张江AI新药联盟正在讨论建立AI行业标准。他建议可以参考“生产质量管理规范”(GMP)中的要素,如人、机、料、法,对AI制药确定一套评估标准和配套的操作规程。各企业可以比较各自不同靶点的优势,重新思考梳理业务管线布局。
与此同时,未来AI真正成熟后,国家药品监督管理局药品审评中心(CDE)也可以在审评中参考AI做出的预测,评估药物进入人体的作用,减少临床试验资源浪费。






