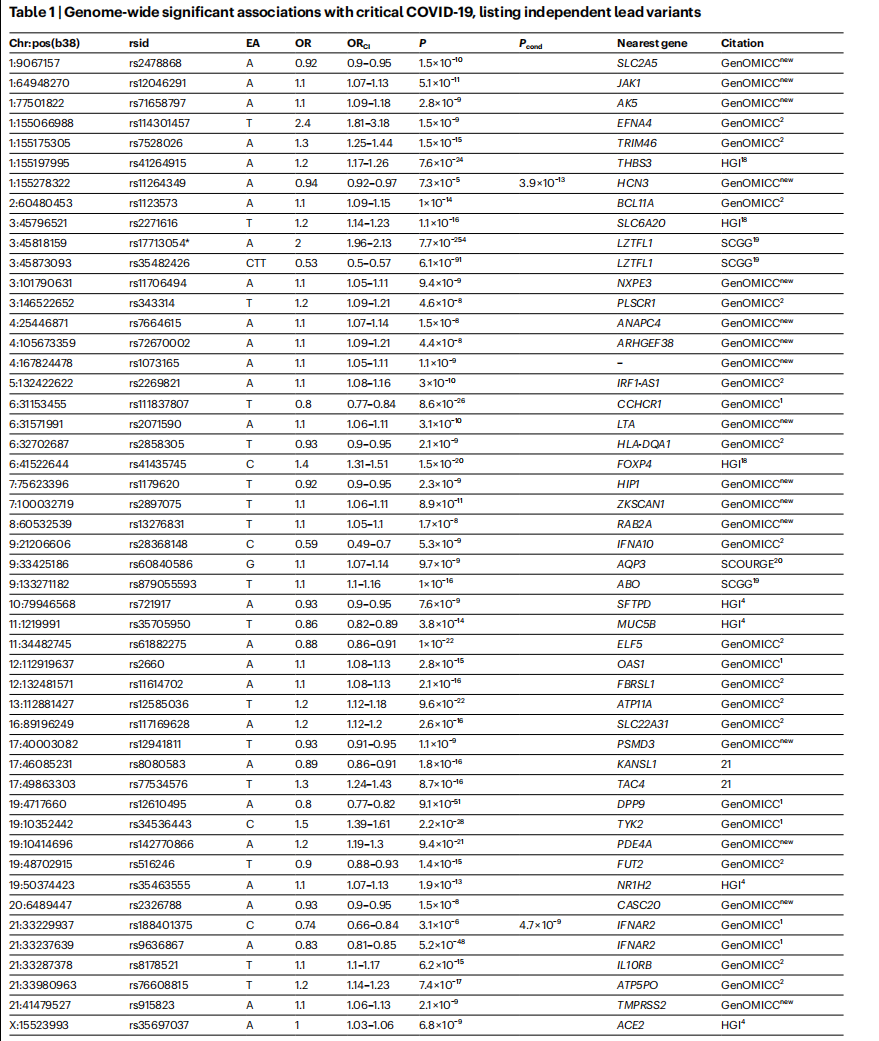
全基因组关联分析揭示的与新冠危重症相关的主要突变体。图片来源:贝利团队论文

·贝利团队共分析了24202例新冠危重症患者,确定了与新冠危重症相关的49个关键遗传变异,且其中16个从未被报道过。为探索其潜在的治疗意义,贝利团队还进一步确认了114个潜在药物靶点。
新冠危重症是基因惹的祸?
当地时间5月17日,《自然》(Nature)杂志在线刊登了英国爱丁堡大学(The University of Edinburgh)遗传学家、重症监护学顾问肯尼斯·贝利(Kenneth Baillie)团队题为《全基因组关联和荟萃分析确定COVID-19背后49个关键的遗传变异》(GWAS and meta-analysis identifies 49 genetic variants underlying critical COVID-19)的研究论文。在这项研究中,贝利团队确定了与新冠危重症相关的49个关键遗传变异,且其中16个从未被报道过。为探索其潜在的治疗意义,贝利团队还进一步确认了114个潜在药物靶点。
“这些结果加深了我们对新冠危重症的发病机制的理解,并突出了新的疾病生物学机制,其中一些机制具有直接靶向治疗的潜力。”贝利团队在论文中写道。
在这项研究中,贝利团队共纳入了24202例新冠危重症患者的数据,其中包括来自重症监护易感率和死亡率遗传学(GenOMICC)研究项目的11440例,致力于预防呼吸道疾病死亡的全球临床医生组织(ISARIC4C)的676例和西班牙联合解锁新冠宿主基因研究项目(SCOURGE)的5934例,以及新冠人类遗传学倡议(HGIv62021)发布的数据。
贝利是GenOMICC研究项目的负责人,此前,GenOMICC开展的全基因组关联(GWAS)研究提出了可能影响约1万名新冠危重症患者疾病严重性的遗传因素。在这次的最新研究中,贝利团队利用进一步的GWAS结果进行了全面的荟萃分析,发现了49个与新冠危重症相关的常见基因序列,基因水平的分析发现了196个显著相关的基因。
全基因组关联分析是指在人类全基因组范围内找出存在变异的基因序列,从中筛选出与疾病相关的分子遗传标记,即单核苷酸多态性(SNPs)。

全基因组关联分析揭示的与新冠危重症相关的主要突变体。图片来源:贝利团队论文
贝利团队还进一步探究了这些基因的治疗意义。“尽管大多数先导的基因变异与新冠危重症之间不是直接的因果关系,但在某些情况下,它们表明了改变新冠临床结果的分子机制,在治疗意义上可能具有相关性。”为了探究新冠危重症的疾病机制,贝利团队将GWAS结果与基因和蛋白表达数据相结合,确定了15种与新冠危重症相关的蛋白,其中包括5种新蛋白:QSOX2、CREB3L4、髓过氧化物酶(MPO)、ADAMTS13和甘露糖结合凝集素-2(MBL2)。
其中,MBL2和MPO已被研究充分证明是败血症的生物标志物和潜在的药物靶点。ADAMTS13调节血管性血友病介导的血小板血栓形成,并可能在新冠危重症的高凝状态(指新冠感染患者可能出现的多种复杂的凝血异常,增加血栓风险)中发挥作用。
“还需要进一步的生物学和临床研究来解剖这些位点的遗传证据。”贝利团队表示。
值得一提的是,贝利团队此前曾报道过TYK2(一种靶点蛋白)的高表达和新冠危重症之间的关联,这使得新药巴瑞替尼(baricitinib)被纳入英国的一项大型临床试验,研究结果显示其将新冠肺炎住院患者的死亡风险降低13%。巴瑞替尼是一种用于治疗类风湿性关节炎等疾病的消炎药,其靶点之一是JAK1蛋白,该蛋白参与验证信号传导,与新冠危重症的基因有关。“这为遗传学识别药物靶点提供了概念证明。”贝利团队说。
沿着这一思路,贝利团队评估了现有药物再利用的可行性,确定了几种可能有助于救治新冠危重症患者的靶点。例如,分析显示,编码典型炎症因子、肿瘤坏死因子(TNF)的基因表达与新冠危重症之间显著正相关,这提示抑制TNF信号通路可能是治疗新冠危重症的有效方法。再比如单核细胞中PDE4A高表达的遗传倾向与新冠相关,几种现有药物对PDE4A在多种炎症性疾病的抑制作用正在研究中。
贝利团队表示,其研究结果证明了宿主遗传学揭示疾病的核心机制的能力。除了ACE2,贝利团队还在促进病毒入侵的关键宿主蛋白酶TMPRSS2中检测到了全基因组的显著关联。
贝利团队也在论文中指出了其研究的局限性:仅根据这些数据,不能确定新冠危重症疾病进展的因果效应,因为研究纳入的大多数病例是在接种疫苗之前招募的,目前其团队还没有足够的统计能力来分析疫苗接种的遗传效应。此外,大多数病例都是欧洲血统,未来的研究需要考虑人口的多样性。






