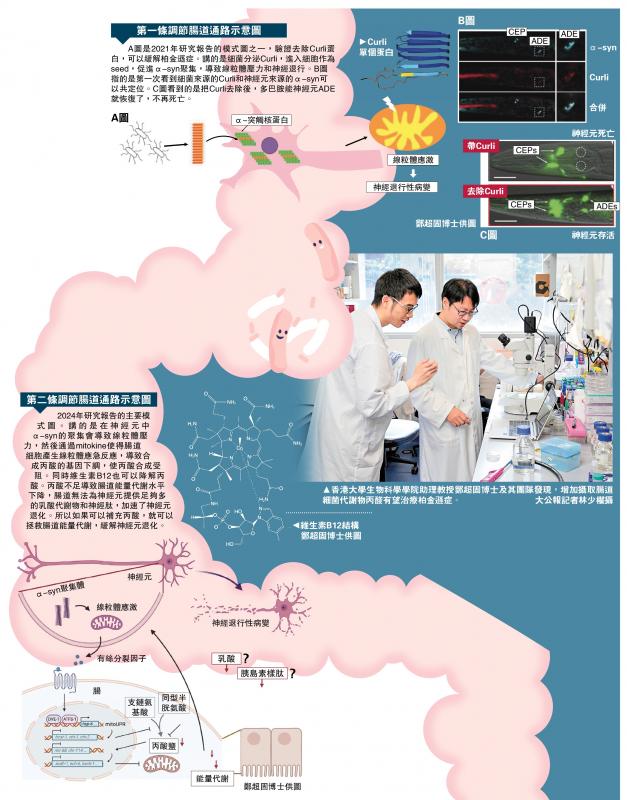
圖:香港大學生物科學學院助理教授鄭超固博士及其團隊發現,增加攝取腸道細菌代謝物丙酸有望治療柏金遜症。
腸道微生物不僅與治療兒童自閉症、跨年齡的新冠失眠群體息息相關,就連長者群體的高發疾病,腸道微生物都扮演着很重要的角色。
香港大學(港大)生物科學學院助理教授鄭超固領導的研究小組發現,與傳統治療相比,通過調節腸道細菌產生的代謝物,可能會更有效地預防或治療柏金遜症等神經退化性疾病,例如在今年成功發現透過增加丙酸,能有效抑制α-突觸核蛋白(α-syn)引起的神經元死亡和運動能力缺陷,緩解柏金遜症狀。此研究為神經退化性疾病的治療開闢了新方向。
柏金遜症的發病原理源於多巴胺能神經元中α-突觸核蛋白(α-syn)的聚集。鄭超固表示,在緩解柏金遜症方面,團隊到目前為止發現了兩條調節腸道代謝物的通路:其一是設法拿走大腸桿菌分泌的Curli蛋白,因Curli蛋白能促進多巴胺能神經元中α-突觸核蛋白(α-syn)聚集;其二是透過增加丙酸水平,包括去除誘導丙酸分解的維生素B12或直接補充丙酸,都能抑制α-突觸核蛋白(α-syn)引起的神經元死亡和運動能力缺陷。第二條通路亦是今年最新的研究成果,而其研究基礎也離不開當年第一條通路的發現成果。
找出38個促使神經退化基因
鄭超固受到美國加州理工學院(Caltech)關於小鼠柏金遜症模型研究啟發,開始進行秀麗線蟲的柏金遜症模型研究。2019年,鄭超固的研究團隊利用秀麗線蟲的柏金遜症模型對腸道細菌(大腸桿菌)進行了基因篩選,鑒定出38個促使神經退化的基因,鄭超固表示,這項研究是一系列工作,鑒定出的38個基因已經列入「待辦事項」(to do list)清單上,團隊一直持續對38個基因進行研究。
研究團隊首先發現了第一條調節腸道代謝物的通路,他們集中研究這38個基因中的csgA和csgB基因,並於2021年取得了重大進展,成為世界上第一個證實大腸桿菌分泌的Curli蛋白能夠進入宿主神經元,促進多巴胺能神經元中α-突觸核蛋白(α-syn)聚集,引起柏金遜症。
團隊又在今年成功發現第二條調節腸道代謝物的通路,他們對38個基因中的cobS、btuR和eutT基因進行研究,發現三個基因能幫助維生素B12的合成。不過,團隊在秀麗線蟲模型中發現,維生素B12在模型中是一個「不好的東西」,因研究發現維生素B12會促進丙酸的分解,即若維生素B12變少,能夠緩解柏金遜症的丙酸就會變多。
基於以上的發現,鄭超固團隊假設增加丙酸的水平可能會抑制神經退化的病變。團隊使用了特定的秀麗線蟲,即在其中表達了α-突觸核蛋白(α-syn)以模擬柏金遜症的神經退行性變化,把不同濃度的丙酸添加到秀麗線蟲的生長培養基中,以評估其劑量依賴性效果。
團隊不僅進行了行為測試,以評估秀麗線蟲的運動能力和生存率,還使用了RT-qPCR等分子生物學技術來分析秀麗線蟲中與丙酸代謝和神經健康相關的基因表達變化。他們亦採用了生理測試,如氧氣消耗率測量評估丙酸對秀麗線蟲的影響,還對實驗數據進行了統計分析,以確定丙酸補充和維生素B12缺乏對神經退行性變化的顯著影響。
為治療神經退化病開闢新方向
通過研究,團隊發現患有柏金遜症的動物的丙酸水平比正常動物低,並證實透過增加丙酸水平,包括去除誘導丙酸分解的維生素B12或直接補充丙酸,都能抑制α-突觸核蛋白(α-syn)引起的神經元死亡和運動能力缺陷。鄭超固指出,令人意外的是,原來丙酸的神經保護效應是由神經元和腸道之間的器官信號傳遞引起的。這項研究對關於神經退化性疾病中小分子代謝物在腸─腦相互作用中所扮演角色提出了新見解,同時也為神經退化性疾病的治療開闢了新方向,相關研究結果已經在著名生物學期刊《細胞報告》(Cell Reports)上發表。
鄭超固表示,儘管這些發現具有重要意義,但它們並不是一個臨床實驗。對於未來的規劃,他表示,目前團隊正在建立小鼠和幹細胞模型,希望將秀麗線蟲模型、小鼠模型和人類神經元培養模型相結合,以進一步驗證這些發現。






